| 杨程课题组揭示肝癌免疫逃逸新机制——HIF-1α/YTHDF2/PFKL轴调控MDSC代谢促进肝癌进展 |
| 发布人:蒲仕明 发布时间:2026-01-08 浏览次数:19 |
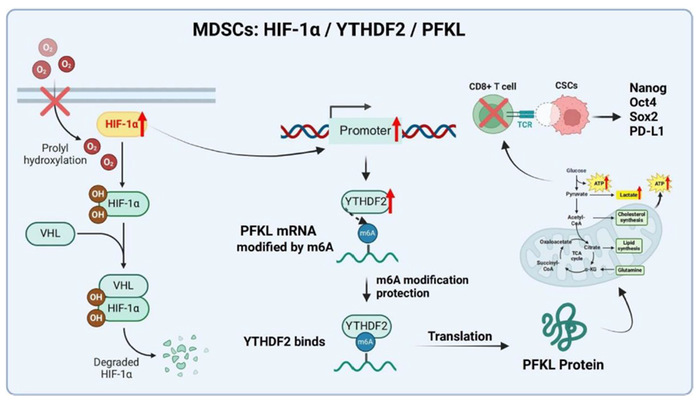
肝细胞癌是常见的恶性肿瘤,其高度异质性和免疫抑制性微环境常导致治疗反应不佳。髓系来源抑制细胞(MDSCs)是肿瘤微环境中关键的免疫抑制细胞,但其在肝癌中如何被精准调控,仍是研究难点。 本研究发现,在肝癌缺氧微环境中,关键转录因子HIF-1α被激活,并直接启动下游基因YTHDF2的表达。YTHDF2作为一种m6A RNA修饰的“阅读器”,能够特异性识别并稳定糖酵解关键限速酶PFKL的mRNA,从而显著增强MDSCs的糖酵解代谢活性。这种代谢重编程不仅为MDSCs提供能量,更使其分泌大量乳酸等免疫抑制分子,进而压制抗肿瘤的CD8⁺ T细胞功能,并促进具有自我更新能力的肝癌干细胞(CSCs)的存活与免疫逃逸。 研究通过体外细胞实验和小鼠体内模型证实,阻断HIF-1α或YTHDF2可有效抑制MDSC的糖酵解和免疫抑制功能,恢复T细胞杀伤活性,并显著延缓肿瘤生长。该研究不仅从代谢与表观遗传交叉的新视角,阐明了肝癌免疫逃逸的一条核心通路,也为未来开发靶向HIF-1α/YTHDF2/PFKL轴的联合免疫治疗策略提供了重要的理论依据。 研究成果以《Hypoxia-Induced m6A modification via YTHDF2 stabilizes PFKL to fuel MDSC Glycolysis and hepatocellular carcinoma progression》为题,发表在国际期刊《Functional & Integrative Genomics》(中科院二区)。论文第一单位为广西师范大学生命科学学院,我院教师郭子琦为论文第一作者,杨程副教授为论文通讯作者,杨程课题组研究生黄雨莹、董晓玲等参与了研究工作。本研究获得了国家自然科学基金、广西自然科学基金等项目的资助。
论文链接:https://doi.org/10.1007/s10142-025-01743-6 |